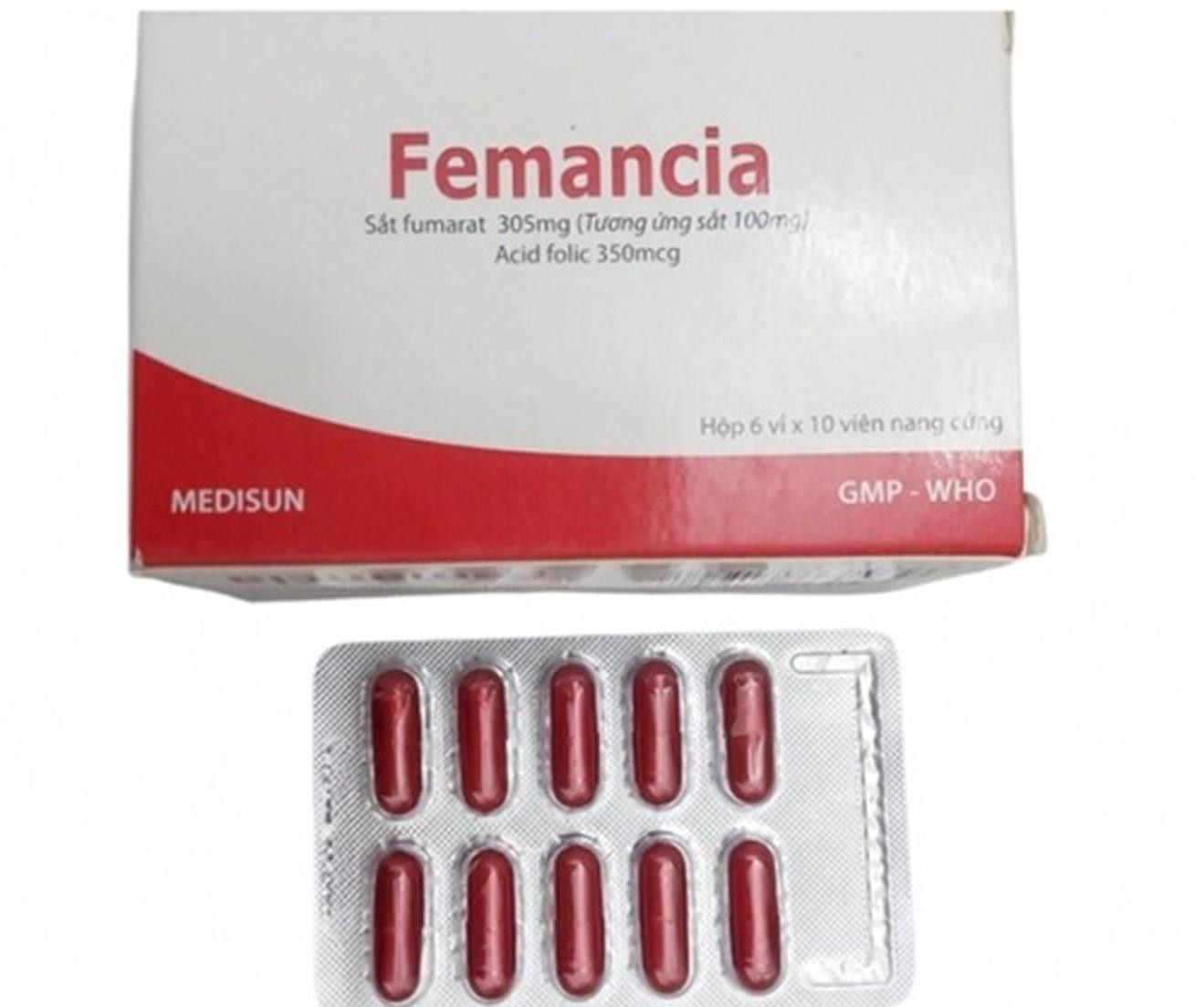
Thuốc Femancia là viên nang cứng, có thành phần Sắt nguyên tố (dưới dạng Sắt fumarat 305 mg) 100 mg và Acid Folic 350 mcg, do Công ty Cổ phần Dược phẩm Me Di Sun sản xuất tại địa chỉ: 521 Khu phố An Lợi, Phường Hòa Lợi, TP Hồ Chí Minh (địa chỉ cũ tại Thị xã Bến Cát, Bình Dương).
Theo Cục Quản lý Dược, việc thu hồi được thực hiện theo quy định tại điểm b, khoản 1, Điều 62 Luật Dược, do thuốc Femancia bị rút giấy đăng ký lưu hành. Điều này đồng nghĩa với việc thuốc không còn đủ điều kiện sản xuất, lưu hành tại Việt Nam kể từ ngày 16/7/2025.
Cục yêu cầu Công ty Me Di Sun phối hợp với các nhà phân phối tổ chức thu hồi toàn bộ thuốc Femancia đang lưu hành trên thị trường, bao gồm cả tại các cơ sở kinh doanh dược, cơ sở khám chữa bệnh và các đơn vị, cá nhân sử dụng thuốc. Thời hạn hoàn thành thu hồi là 15 ngày.
Sau khi hoàn tất, trong vòng 3 ngày, công ty phải báo cáo kết quả thu hồi cho Cục Quản lý Dược và Sở Y tế TP.HCM theo đúng quy định.
Đáng chú ý, vào tháng 3/2025, Cục Quản lý Dược từng thông báo thu hồi 2 lô thuốc Femancia do không đạt tiêu chuẩn về chỉ tiêu định lượng và độ hòa tan. Hai lô thuốc bị thu hồi khi đó gồm:
Lô 031222: Ngày sản xuất 2/12/2022, hạn dùng 2/12/2025
Lô 020223: Ngày sản xuất 21/2/2023, hạn dùng 21/2/2026
Những lô thuốc này bị phát hiện vi phạm mức độ 2, gây nguy cơ ảnh hưởng tới hiệu quả điều trị và an toàn cho người sử dụng.
Giám sát việc thu hồi, xử lý vi phạm
Cục Quản lý Dược yêu cầu Sở Y tế TP Hồ Chí Minh kiểm tra, giám sát quá trình thu hồi của Công ty Me Di Sun, đảm bảo việc thu hồi được thực hiện triệt để và thuốc không còn khả năng tiếp tục lưu hành, sử dụng.
Sở Y tế các tỉnh, thành phố được yêu cầu thông báo rộng rãi đến các cơ sở y tế, nhà thuốc, đồng thời công bố thông tin thu hồi trên trang web chính thức của Sở. Những đơn vị không chấp hành sẽ bị xử lý theo quy định pháp luật.